
刘毅
助理研究员
摘要:根据肿瘤的分子分型进行个体化治疗是肿瘤精准医疗的精髓,然而肿瘤处在不断的发展变化过程之中,实时检测就显得尤为重要,组织活检虽然说是分子分型的首选,但是它的获取非常困难,在无法获得组织的时候,外周血中ctDNA和CTC就能够成为良好的补充。ctDNA的优势是检测会非常方便,但很难确定是否是肿瘤来源,而CTC的检测虽然相对困难,但是在其上面可以实现的分子分析的种类却非常多。总的来讲,以上检测手段各具优缺点,如果能将其合理的结合起来来使用使它们互为补充,就会为患者提供更加全面的信息,从而使得患者的个体化治疗变得更加精确。
事实上,精准医疗的概念早在几年前就已经有人提出了。美国NIH(美国国立卫生研究院)对于精准医疗的定义是在疾病的预防和治疗过程中要考虑到个体在基因、环境以及生活等方面的个体差异,其中关键的一点就是基因方面的差异。另外,我们也注意到NIH专门为精准医学设立了一个近期目标,那就是癌症,具体涉及靶向药物的创新性临床试验、联合治疗的使用、如何克服药物的耐药等。
其实,NIH之所以将癌症作为精准医疗的近期目标,是因为癌症是最具异质性的人类疾病,不同的癌症患者之间,甚至在同一患者的肿瘤不同部位之间都存在着广泛的异质性,而且具有不同的分子特征,只有精确的了解这种差异,所谓的个体化精准医疗才会成为可能。
以肺癌为例,从最初的KRAS到EGFR,再到最近的ALK、BRAF,以及C-MET等,我们对于肿瘤发生发展过程中的这些驱动基因有了不断深入的认识和理解,以这些驱动基因为靶标而设计的一些药物,展现出了非常有效的治疗效果。因此,关于癌症的精准治疗,NCI(美国国家癌症研究所)是这样定义的,根据患者肿瘤的特定的基因异常来研发独特的个体化治疗策略。然而,肿瘤还有一个非常重要的特征,也就是它的异质性是不断在发生动态变化的,也是肿瘤目前治疗所面临的重要挑战。
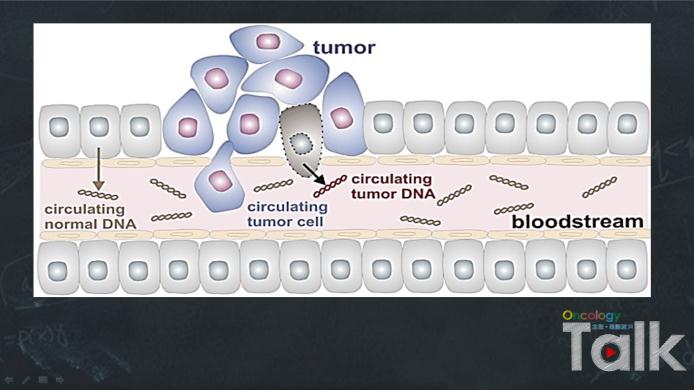
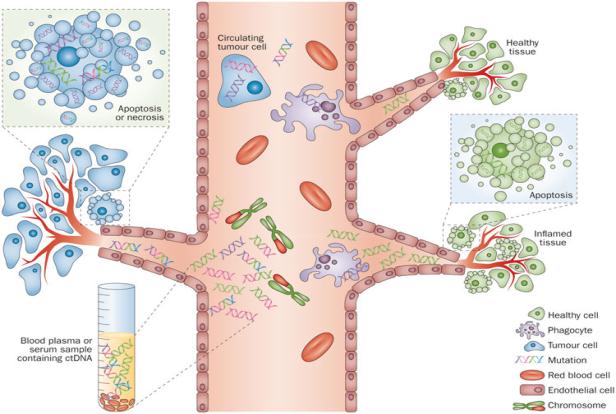
在肿瘤的实际治疗过程中,很多患者都会经历很多线的治疗,每一次疾病的进展代表的其实都是患者肿瘤在异质性方面的改变,严格来讲只有取到患者进展之后的肿瘤组织,并对其进行相应分析才有可能为患者的后续治疗制定更加精确的治疗方案 。然而遗憾的是,临床常规通过CT或B超引导下组织穿刺活检是个非常痛苦的过程,很多患者很难以接受。但是,相比较而言,外周血的获取则要容易的多,在外周血中有来自于肿瘤的游离的核酸,也有来自肿瘤的循环肿瘤细胞CTC,它们都是非常适合进行实时动态检测的样品。

在ctDNA方面,研究发现,采用ctDNA检测EGFR突变,阳性患者使用TKI药物的有效率高达70%以上,只不过,阴性患者仍然还有较高的有效率,这提示在这些结果中可能还存在一些假阴性的结果。针对这样的结果,进一步分析其原因,在外周血中肿瘤来源的细胞或DNA含量一般来说比较少,而且其中混有大量正常的细胞或游离的一些DNA,这使得阳性结果不容易检出。相应的,具体的解决策略也分为两个方面:其一,进一步提高检测方法的敏感性;其二,提高样品中肿瘤来源核酸或细胞的比率,在这方面,CTC可能是其中的一个解决方案。关于第一个方面,近年来不断发展微滴式数字PCR就可以实现对检测标本的绝对定量,而检测的敏感度可以高达0.01% 。近年来,我们看到将该技术应用外周血中标本的突变检测,不管是乳癌患者的PIK3CA突变检测,还是肺癌的EGFR突变检测方面均取得了非常好的效果,显示出了良好的应用前景。
那么,我也和医药企业的创新中心合作,建立了一个自主的ddPCR方法,该方法的敏感性可以达到0.04%,在跟组织学结果的对比中取得了非常好的效果,而我们近期也把这样一个技术应用到了胸水标本的检测里面,也是取得了很好的检测结果。另外关于外周血标本的工作也在进行之中。
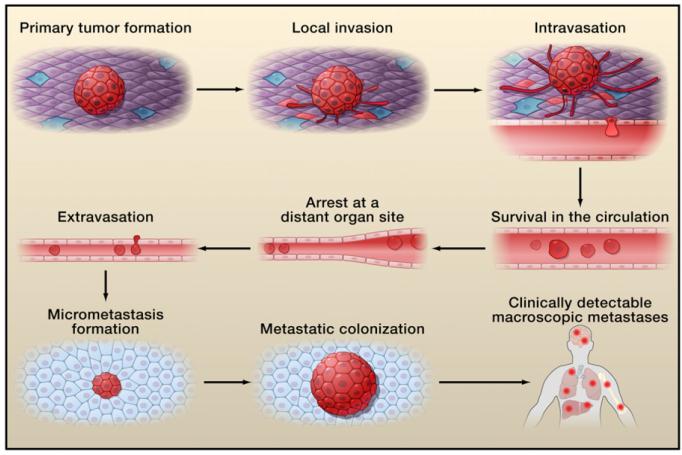
CTC的发生和出现是肿瘤发生转移的关键步骤,一方面它代表了原发灶的肿瘤浸润进入血管的转移能力,另一方面它也代表了远端形成转移灶的潜能。因此,CTC的出现是一个不良预后的指标,同时,CTC还被认为是一种液体活检的工具,可以通过它对患者进行实时的分子分型 。那么,CTC检测的主要理论依据主要是因为90%以上的恶性肿瘤都是上皮来源的,而这种类型的细胞与血液系统的细胞,有着截然不同的基因表达谱和生物学特性,正是利用这种差别从而将这些细胞与血液系统的细胞分离开。
在所有的CTC检测技术中,唯一通过美国FDA以及我国CFDA批准的用于临床的是CellSearch系统,军事医学科学院附属医院作为牵头单位曾参与了这个系统的国内注册实验,在中国人群中再次证实了CTC强大的预后价值。而在CTC的分型方面,我们发现,相比于组织学的HER2状态,CTC的HER2表达与抗HER2药物治疗疗效的相关性更好。近期的另外一项研究再次验证了上述结果同时还发现组织学HER2和CTC HER2的检测时间间隔越长组织学和CTC HER2之间出现不一致的比率就会越高,这进一步提示了实时动态检测的必要性。
当然,Cellsearch只是第一代的CTC检测技术,本身也还是存在一定的缺陷和不足,这些正是新一代的CTC检测技术力图解决的问题,其中最具代表性的就是CTC-chip技术,由哈佛的研究团队研发的。相比于CellSearch技术来说, CTC-Chip技术的整个细胞检出率有了明显的提升,通过这个技术,也可以实现肺癌患者的EGFR突变,从检测的效果上来说要优于ctDNA的结果。近期,哈佛的团队又对这个技术做了进一步改进,使得检出效率有了进一步的提升,后续分析更方便,改进之后的技术可以实现CTC的体外培养并将其用于体外的药敏实验,寻找潜在的药物组合或研究药物耐药的机制 ,这样的技术也可以针对CTC开展各种各样的实验,对参与肿瘤转移的机制进行深入的了解,为未来的药物研发提供依据。
正是由于CTC这样的应用前景使得CTC相关的技术受到了越来越多的关注。之所以这样,是因为CTC是后续各种分析的源头之水,只有拿到数量和质量完全合格的CTC,后续的各种免疫分型、原位杂交、突变、表达以及基因组的测序分析等等才会成为可能,也只有这样,才能够实时的指导肿瘤患者的个体化精准医疗,并且深入的了解肿瘤的内在机制。而这正是CTC研究的未来,也是这个领域最吸引人的地方。
根据肿瘤的分子分型进行个体化治疗是肿瘤精准医疗的精髓,然而肿瘤处在不断的发展变化过程之中,实时检测就显得尤为重要,组织活检虽然说是分子分型的首选,但是它的获取非常困难,在无法获得组织的时候,外周血中ctDNA和CTC就能够成为良好的补充。ctDNA的优势是检测会非常方便,但很难确定是否是肿瘤来源,而CTC的检测虽然相对困难,但是在其上面可以实现的分子分析的种类却非常多。总的来讲,以上检测手段各具优缺点,如果能将其合理的结合起来来使用使它们互为补充,就会为患者提供更加全面的信息,从而使得患者的个体化治疗变得更加精确。
期待未来能有更多的学者加入到讲者的队伍中来,大家一起分享观点,交流学术,为肿瘤规范化的个体治疗以及转化医学研究的开展,贡献我们的力量。