
张俊
副主任医师
关于胃癌腹膜转移的防治策略,主要有胃癌、腹膜转移和防治等三个关键词。但是在具体临床实践中存在不少困难和障碍。主要因为:(1)发生率高:胃癌的腹膜转移是胃癌转移的主要传播途径,接近20%的胃癌患者,在术前或术中即被诊断有腹膜转移。超过50% 的胃癌患者,在实施了根治性切除手术后,发生腹膜转移。(2)早期诊断难:转移一直是胃癌临床治疗的难点,而腹膜转移一直是难中之难。目前,胃癌腹膜转移的诊断主要依靠外科剖腹探查、腹腔镜以及影像学等方法进行,而腹膜转移以微转移为主, 从腹腔内癌细胞存在到形成肉眼腹膜转移结节需要6-8个月,由于腹膜瘤结体积小、体积密度低,限制了CT、PET-CT的使用。此外,在形态学的角度,肿瘤的诊断还存在同病异影和异病同影的问题,都导致早期诊断非常困难。(3)生存期短:晚期胃癌不可手术切除的患者中,腹膜转移的发生率占一半以上;可行手术切除的患者,术后发生的转移主要是腹膜转移。研究显示,腹腔冲洗液细胞学检查阳性的患者,5年生存率仅为12.3%。腹膜转移胃癌患者,5年生存率仅为8.3%。
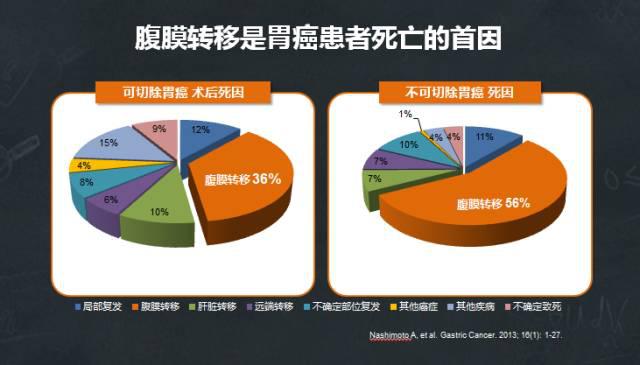
一项回顾性研究分析了自2002~2009年日本208家医院13,626例原发胃癌患者的数据,数据覆盖手术方式、病理学诊及生存结果等53个项目,患者的5年随访率高达83.3%。研究结果显示,无论是可切除还是不可切除患者,腹膜转移均是患者死亡原因的首位。腹膜转移最终导致顽固性癌性腹水、肠道梗阻、恶液质, 成为胃癌死亡的主要原因。
何早期判断或诊断胃癌腹膜转移?通过腹膜的游离癌细胞或腹腔冲洗液中找到的相关癌细胞,是否可诊断为胃癌腹膜转移?这存在着假阳性和假阴性的问题。
腹腔游离癌细胞阳性是胃癌预后的独立预测因子,临床上,日本胃癌协会推荐的一种腹腔脱落癌细胞检查的方法,对术中指定部位倾注生理盐水的量和间隔时间等均有要求,抽吸术中灌洗液(或腹水)后,进行离心、涂片、染色,以及镜下观察。据报道,该方法的敏感性较低为11~80%左右,特异性与准确率为70~90%。
借助免疫组织细胞学、病理学、影像学、以及相关分子技术等方法手段可以提高癌细胞的检出率,同时要注意通过多种方式提高检出率的同时可能会带来假阳性的结果。
目前,腹水细胞的分子生物学分析方法主要有细胞学涂片(ECC)、癌标志物免疫细胞化学方法(定性),以及癌标志物 RT-PCR mRNA检测(定性、定量)等,如CEA、CK20、MUC 1、Laminin、ephrin B4和matrilysin。
腹腔脱落癌细胞检查合并遗传学分析能够提高检出率,敏感性较高,临床上可用于或目标导向下的诊治,或预警和预测,预警是提示患者预后的情况和发生腹膜转移转的风险有多大,预测对寻找针对肿瘤的敏感性和特异性药物有指导意义,两种检测方法的结合能够更好的预测患者的预后。此外,检查时要注意标本采集、检测标准高以及操作复杂,会导致一定的假阳性率。
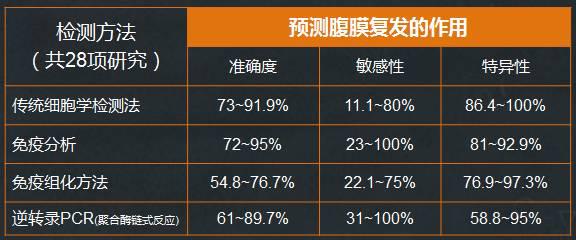
2012年有研究者进行了一项检索1998年1月~2009年12月31日Medline、EMBASE和科克伦对照试验注册登记库,检出评价腹腔游离细胞检测方法预测腹膜复发的文献,共纳入28项研究,对比传统细胞学检测法、免疫分析、免疫组化方法和逆转录PCR(聚合酶链式反应等方法的敏感性和特异性,研究结论是对4种检测方法来说,预测腹膜复发的准确度、敏感性和特异性范围均较宽。未来能否将腹膜细胞学检查纳入胃癌的临床决策取决于是否有快速、准确的腹腔游离癌细胞检测方法。
腹膜转移早诊困难,确诊为腹膜转移后预后极差,如何解决这一难题?界定腹膜转移高风险患者,早期预防腹膜转移发生,选择有效方案等是比较公认的干预腹膜转移的方法。
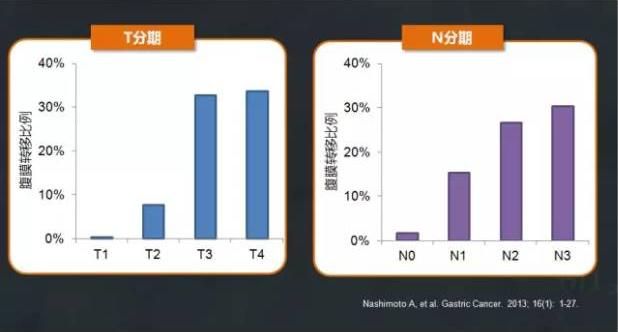
日本一项回顾性分析了自2002年至2009年日本208家医院13,626例原发胃癌患者的数据,数据覆盖手术方式、病理学诊断及生存结果等53个项目,患者的5年随访率高达83.3%。如图上所示,随着疾病临床进展(临床T分期及N分期),腹膜转移患者比例会进一步升高。
胃癌研究者和胃癌的生物学研究者共同思考的一个话题,即胃癌腹膜转移是胃癌发生的早期事件还是晚期事件?如果是晚期事件,那么对腹膜转移进行干预就是科学论;如果是早期事件,意味着在发生胃癌的时候就主动发生腹膜转移,形同宿命论。一些肿瘤的局部进展非常严重,但是患者最终并非因腹膜转移而死亡,而有些患者局部肿瘤并不非常明显,在早期就发生了腹膜转移,但是仅限于腹膜转移,其它内脏脏器转移都很少,我们如何从生物学上理解这个问题?
胃癌腹膜转移这个命题在生物学上还需要我们深入深究,如果是晚期的事件,临床上可以提前加以干预,在辅助治疗阶段及早使用一些能有效抑制腹膜转移的药物,在理论上,较高的腹膜腔内药物浓度对延迟腹膜转移时间和发生时间有一定的帮助。
韩国的一项纳入了2328例胃癌患者的回顾性研究结果显示,年轻患者、弥漫浸润型、未分化型、浆膜浸润阳性(T4)、淋巴结转移(N2/N3)以及全胃切除等是术后腹膜复发的高风险因素。
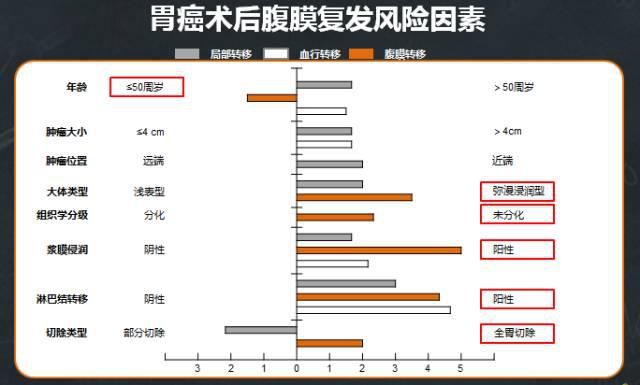
需要注意的是,上图表示的是不同复发形式独立风险因素的逻辑回归分析结果(p<0.05),并非否认外科切除的重要性,如果胃切除或淋巴结清扫不彻底,则会很快发生局部复发及淋巴结复发。当进行R0切除和彻底的D2淋巴结清扫后,显著降低了胃癌术后的复发率(主要是局部和区域淋巴结复发),这个时候腹膜复发就显得尤为显著。
一个有趣的想象是,在上述一系列高风险因素中,没有一个明确的分子因素,在当今精准医疗时代,各类的高通量基因测序指导临床的有几个?当我们向分子水平进行深入研究的目的是要找到实实在在的可以指导临床的证据,而非只是检测诸多基因,显然,目前我们尚未到达真正的精准指导临床的时代。所谓的基因精准治疗或者基因指导下的治疗,需要一个大样本的标本库或者一个完整的数据库,基于大数据或大样本的分析,可以帮助我们总结凝练出临床可用的一组标志物,而不是一堆标志物。
胃癌腹膜转移的预防方面,一个关键的问题是全程管理,包括早期风险评估、手术中的防护、术中的干预措施以及术后的辅助化疗等。此外,防还应该包括如何遴选出高危人群以便对其及时的进行评估和干预,进行整体监测。预防,不仅仅包括药物预防,还有预防的时机和进行预防的技术,如手术无瘤技术、术中腹腔灌注化疗、术后早期腹腔内化疗以及术后辅助化疗等等方式,都是预防胃癌腹膜转移的手段。简言之,预防胃癌膜转移的核心是在空间上彻底清除肿瘤,在时间上,于残余的癌细胞进入指数分裂期的最佳时间给予干预。
腹腔热灌注化疗和术后早期腹腔化疗可改善患者预后,一项荟萃分析1,684例患者中接受术后辅助腹腔化疗与没有接受术后辅助腹腔化疗的患者相比,前者更具有生存优势。
Kuramoto等前瞻性比较了术前腹腔灌洗术后辅助腹腔化疗与仅术后辅助腹腔化疗的生存时间,结果发现术前腹腔灌洗术后辅助腹腔化疗组的5年生存率是明显提高的。
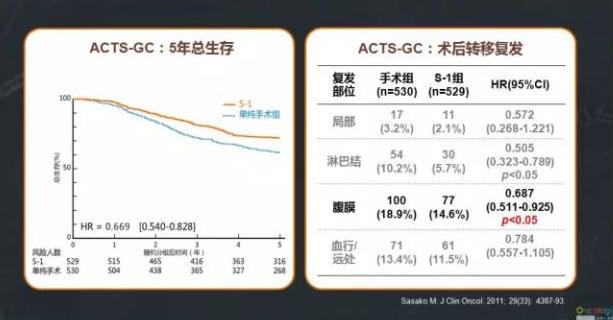
新一代胃癌口服化疗药物爱斯万(S-1),其药理特性针对腹膜转移,能够维持肿瘤和腹膜中的有效药物浓度,辅助化疗显著降低腹膜转移风险的31%。日本胃癌学会第3版《胃癌治疗指南》对于腹腔内冲洗细胞学诊断阳性(CY1)和已切除原发灶CY1患者的治疗推荐是,若无其他非治愈因子,提倡包含标准手术在内的多学科治疗;若原发灶已切除,推荐S-1辅助化疗。对于腹膜转移高风险患者,如T3~4、N2~3、年轻患者、弥漫浸润型、未分化型和全胃切除等,S-1的药理特性针对腹膜,能够进入腹腔杀灭游离癌细胞,ACTS-GC结果显示,S-1辅助化疗可降低腹膜转移风险,以及S-1给药方便更易于术后应用等,使得S-1是预防胃癌术后腹膜转移的优选。
腹膜转移是不可切除胃癌患者死亡的首因,占56%。腹膜转移也是所有转移类型中生存期最短的,约6.4个月。
日本大阪市立大学医学院的一项研究显示,口服单药S-1可将患者中位生存期从118天提高到257天,可以显著延长患者的生存期。同时,患者无严重不良反应。
一项正在进行的随机、开放、III期PHOENIX-GC研究,是以日本晚期胃癌一线标准治疗SP方案为对照,为了进一步探讨S-1与紫杉醇的联合增效作用、系统化疗联合腹腔灌注的疗效以及安全性,以期验证S-1联合紫杉醇用于腹膜转移胃癌的疗效。目前,该研究已完成入组,最终结果将于2015年底发布,相信会对胃癌伴腹膜转移患者临床用药的标准化提供更明确的指导和更确凿的证据。